Fizikalne
osnove svetlobne terapije
Erik
Margan
Institut Jožef Stefan, Eksperimentalna fizika
osnovnih delcev
17.09.2012.
Namen tega prispevka je podati pregled pomembnih pojavov pri svetlobni
terapiji in predstaviti jih v perspektivi fizikalnih procesov na ravni osnovnih
delcev, atomov in molekul.
Fizika pozna štiri vrste energijskih interakcij: močno jedrsko,
elektromagnetno (EM), šibko jedrsko in gravitacijsko, ki si stojijo v
približnem razmerju intenzitet (relativno v primerjavi z EM) 102 : 1
: 10–12 : 10–40. Vendar močna in šibka jedrska
interakcija imata zelo omejen doseg, okoli 10–15m, torej približno
velikosti atomskega jedra, zato nastopata le v jedrskih procesih (spontani
radioaktivni razpad jedra, zlivanje jeder v zvezdah). Velikost jedra je v
primerjavi z velikostjo atoma, oziroma premera elektronskih orbital, kar znaša ~10–10m,
kot muha v katedrali. EM in gravitacijska interakcija imata neomejen doseg
(intenziteta pada s kvadratom razdalje), vendar je gravitacija za celih 40
velikostnih redov šibkejša, zato pride do izraza le v primeru velikih skupin
atomov (za opazen pospešek mora biti vsaj eno telo planetarnih razsežnosti).
Tako edino EM interakcija pride do izraza na mikro-ravni, na makro-ravni pa le
pri povezovanju atomov v večje aglomerate, ker so atomi večinoma navzven
električno nevtralni. Kljub temu, tisto kar v vsakdanjem življenju imenujemo
mehanika, kemija, biologija, so le makroskopski približki, v osnovi gre vedno
le za EM interakcijo. Biološki procesi niso nobena izjema, ne obstajajo
nikakršne posebne 'bio-energije'.
Nosilec EM interakcije imenujemo foton; gre za valovni kvant EM polja,
katerega osnovna lastnost je frekvenca nihanja. Energija, ki jo foton
posreduje, je premo sorazmerna frekvenci. Konstanta sorazmernosti je Planckova
konstanta, katere velikost je bila ugotovljena na podlagi Planckovega zakona
sevanja in znaša h = 6,62×10–34Js (Joule-sekund). Potemtakem
je energija preprosto E = hν, kjer je ν (grška črka nü) frekvenca izražena v
številu period na časovno enoto (sekundo), oziroma v Hz. Ker pa je svetlobna
hitrost zmnožek valovne dolžine (v metrih, [m]) in frekvence, c = λν, lahko energijo izrazimo z valovno dolžino E
= hc/λ.
V fiziki osnovnih delcev energijo namesto v SI enoti Joule [J] (1J = 1Ws =
1VAs) pogosto iz praktičnih razlogov izražamo v elektron-Voltih, [eV]. En eV je
energija, ki jo pridobi elektron pospešen v električnem polju s potencialno
razliko 1V. Pretvorba enot je preprosto deljenje energije z nabojem elektrona: E
[eV] = (E [J])/qe, kjer je naboj elektrona qe
= 1,602×10–19As. To nam omogoča da tudi energijo svetlobe izrazimo v
enotah eV, kar potem lažje primerjamo z učinki ki jo ima svetloba na snov
(preskok elektronov iz nižje orbitale v višjo, ionizacija atoma, itd.). V
Tabeli 1 so podane vrednosti energij, valovnih dolžin, frekvenc, ter optičnega
območja za fotone z energijo od 1eV do 5eV.
Tabela 1
|
Energija [eV] |
Energija [J] |
Valovna dolžina [nm] |
Frekvenca [THz] |
Optično območje |
|
1 |
1.602×10–19 |
1240 |
242 |
Infrardeče (IR) |
|
2 |
3.204×10–19 |
620 |
484 |
Vidna (rdeča) |
|
3 |
4.807×10–19 |
413 |
725 |
Vidna (vijolična) |
|
4 |
6.409×10–19 |
310 |
967 |
Ultravijolična (UV) |
|
5 |
8.011×10–19 |
248 |
1209 |
Ultravijolična (UV) |
|
|
|
(1nm = 10–9m) |
(1THz = 1012Hz) |
|
Da svetloba vpliva na snov je
očitno: če tega ne bi bilo, ne bi videli! Pri interakcijah med sevanjem in snovjo je pomembno
dejstvo, da so elektronske orbitale v atomih energijsko kvantizirane. Snov je
vedno v termičnem ravnovesju s sevanjem. Pri temperaturi večji od absolutne
ničle (0K = –273°C) atomi nenehno sprejemajo fotone iz okolice, tako zajeta
notranja energija se potem odrazi s kvantnimi prehodi elektronov na višje
orbitale; prav tako nenehno atomi s spontanim oddajanjem fotonov oddajajo nazaj
v okolico sprejeto energijo, elektroni pa se povrnejo v nižje orbitale. Na pr.,
osnovno energijsko stanje atoma vodika znaša 13,6eV, in tolikšno energijo mora
imeti foton če naj atomu odtrga elektron iz orbitale. Če je sprejeta energija
fotona manjša od osnovne vezalne energije elektrona, bo elektron preskočil le
na ustrezno višjo orbitalo.

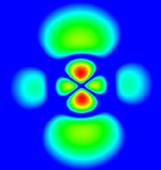
Sl.1: Bohrov model atoma,
absorpcija in emisija fotona; desno: verjetnostna
gostota elektronskih orbital
atoma vodika v vzbujenem stanju
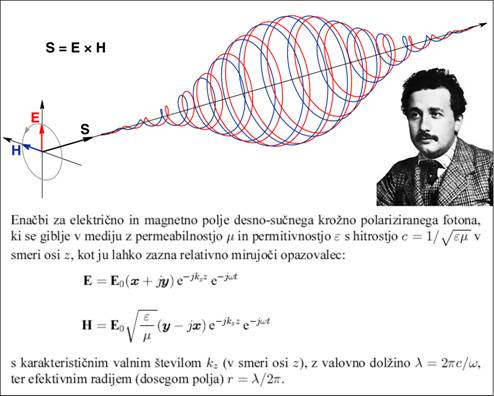
Sl.2: Model fotona kot ga
določata enačbi za električno in magnetno komponento polja
Če so atomi povezani v molekule, vsaka taka sprememba orbitale vpliva na
ostale elektrone v molekuli kot električni sunek, ki se prenese na sosednje
atome, vsi elektroni sledijo spremembi ravnovesja električnih polj in tej
spremembi prilagodijo svoje orbitale. Podobno se zgodi ko atom v vzbujenem
stanju odda foton. V termičnem ravnovesju z okolico molekule nenehno vibrirajo,
in vsakemu načinu vibriranja ustreza določena notranja energija. Pri višji
temperaturi je potem potrebno manj energije za povezovanje atomov ali molekul v
bioloških procesih. Vendar se pri svetlobni terapiji temu želimo izogniti, ker
bi s segrevanjem spodbudili vse procese priblžno enako, cilj pa je selektivno
spodbujanje točno določenih procesov. To dosežemo z ustrezno izbiro valovne
dolžine svetlobe. Monokromaska svetloba, ali svetloba z ozkim spektrom lahko
vpliva le na določene molekularne vezi, ki imajo podobno vezalno energijo,
sicer pa je intenziteta sevanja dovolj majhna da ostale vezi ostanejo v
približnem termičnem ravnovesju.
Molekule so večinoma električno nevtralne, število elektronov pri vseh
atomih je enako številu protonov v jedrih. Vendar nekatere molekule, tudi tako
preproste kot voda (H2O), izkazujejo določeno polarnost. Pri vodi je
to posledica kota ~104°, ki ga tvorita oba vodikova atoma glede na atom kisika.
Ta polarnost ima za posledico vrsto zanimivih lastnosti vode. Tudi druge
spojine imajo stereometrično razporeditev različno, ne vedno simetrično, zato
električna polarnost pripelje do različnih oblik večjih molekul. Tipični primer
so proteinske molekule, ki se zaradi medatomskih sil spontano zvijajo in
oblikujejo dolge spiralne verige. Posledica tega je, da pri velikih molekulah
pride do izraza njihova oblika in sicer se močneje »lepijo« na sebi
komplementarne molekularne strukture, na katere dobro prilegajo.
Sl.3 prikazuje model kompleksne molekule in shematsko ponazarja medatomske
sile ki nastopajo pri različnih oblikah molekule.
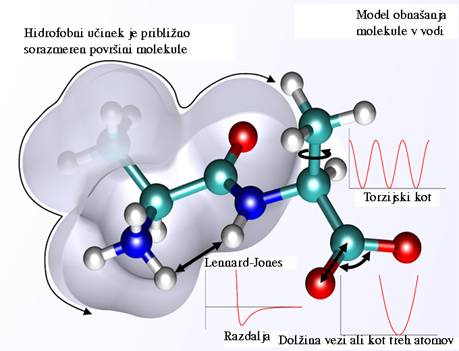
Sl.3: Model makromolekule in prikaz
nekaterih medatomskih sil.
Če navzven ni kakega atoma s polarno vezjo, je hidrofobni učinek približno
sorazmeren površini molekule, molekula se ne bo lepila na vodo. En sam zunanji atom
s polarno vezjo pa popolnoma spremeni ta učinek. Medatomske vezi so pretežno
kovaletnte (z disociacijsko energijo ~1600kJ/mol), razen vodikovih vezi
(~50–70kJ/mol). Vezi med dvema atomoma,
ali kot ki ga tvorijo trije atomi se z razdaljo spreminja v obliki črke U, ima
torej ob določeni razdalji lokalni energijski minimum. Podobno je s torzijskimi
koti med dvema gručama atomov, tam se sila s kotom periodično spreminja,
molekula ima več stabilnih leg, in od zunaj dovedena energija lahko povzroči
preskok iz ene stabilne lege v drugo.
Vendar zaradi zapletene strukture prihaja do pojava posrednih sil. Denimo
med dvema sosednima atomoma, ki pa nista med seboj neposredno vezana (njune
vezi so popolnima zasedene z drugimi atomi), nastopa Lennard–Jonesova sila (LJ),
ki je pri majhni razdalji odbojna, na večji pa privlačna. V termičnem
ravnovesju se molekula postavi v tako obliko da je sila LJ približno enaka nič.
Podobno se dogaja pri dipolnih interakcijah (Debye), bodisi dipol-dipol, ali
dipol-inducirani dipol. Disociacijske energije so v teh primerih med 2 in 9kJ/mol.
Londonove in van der Waalsove sile nastopajo med velikimi sosednimi
gručami, disociacijske energije so v teh primerih manjše od 4kJ/mol.
Posredne sile so lahko v bolj zapletenih molekulah tudi odbojne pri večjih
razdaljah, privlačne vmes in spet odbojne na majhnih razdaljah. To pomeni da
molekula, ki ima v termičnem ravnovesju eno obliko, že ob majhni dovedeni
energiji preide spontano v drugo obliko.
Večina bioloških procesov je odvisna prav od takih molekularnih povezav.
Take vezi so razmeroma šibke, energijsko med 3eV in 4eV. Tako nikakor ni
naključje da je naša koža občutljiva šele na UV sevanje. UV spekter se nahaja
na valovnih dolžinah krajših od ~390nm, čemur ustreza energija 3,3eV.
Obstajajo molekule, ki svojo strukturo lahko spreminjajo pod vplivom od
zunaj dovedene energije, ne da bi spremenile svoje kemične vezi. To so številni
izomeri. Najbolj pogosto imajo izomeri meta-stabilne dvojne vezi, ki jih z
razmeroma nizko energijo spremenimo v enojne vezi, hkrati pa nastanejo dvojne
vezi med drugimi atomi, od katerih je ponavadi eden ioniziran (najbolj pogosto
vodikov atom). Pri tem so biološko najbolj zanimivi funkcionalni foto-izomeri,
kjer je biološka funkcija molekule pogojena z njeno obliko, ki se spreminja pod
vplivom svetlobe: če se ta spremeni so tudi molekularne lastnosti drugačne.
Najbolj znan primer je bilirubin, ki povzroča zlatenico pri novorojenčkih.
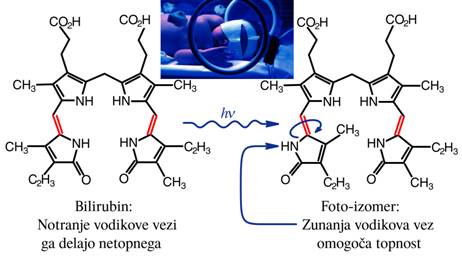
Sl.4: Foto-izomerizacija bilirubina
Navadno ima molekula bilirubina štiri na dušikove atome vezane vodike,
obrnjene navznoter; na zunaj so obdani s ogljikovimi atomi, ki nimajo izražene
polarnosti in izkazujejo hidrofobni učinek, zato se bilirubin v vodi ne topi in
se ne izloča. Toda če ga osvetlimo z modro svetlobo (med 430 in 470nm) se ena
od dvojnih ogljikovih vezi obrne in prestavi vodikov atom na zunanjo stran; ta
vodik se lepi na vodne molekule, kar nato omogoča da se bilirubin izloči iz
telesa. Poznamo veliko število molekul z vsaj dve izomerni obliki, vendar
njihove lastnosti v mnogih primerih niso še dovolj znane, zato na tem področju
v prihodnje lahko pričakujemo pomembna dognanja z možno uporabo pri svetlobni
terapiji.
Omenjenih 3,3eV je energija pod katero EM sevanje nima nobenega direktnega
biokemičnega učinka, fotoni z nižjo energijo le segrevajo snov ali spreminjajo obliko
molekul, ne morejo pa pretrgati kemičnih vezi.
Izjema pri tem so le katalitično podprti procesi, kjer do ionizacije snovi
pride le ob neposredni prisotnosti molekul s katalizatorskim učinkom, ta je
predvsem v obliki močnega lokalnega polja na konici molekule. Katalitično
podprti procesi lahko potekajo že ob energijah ~1eV. Ravno ti procesi so tarča
nizko-energijske svetlobne terapije.
Tovrstne procese najdemo predvsem v mnogih encimskih reakcijah (več kot
4000 znanih procesov), ter na celičnih membranah, kjer igrajo pomembno vlogo
pri odpiranju in zapiranju membranskih por in s tem regulirajo prepustnost
membrane za hranljive snovi od zunaj in izločanje metaboličnih produktov iz
notranjosti celic.
Izredno pomembni so tudi procesi v mitohondrijih, kjer poteka proces
celičnega dihanja in energijske pretvorbe, ter sinteze nekaterih pomembnih
signalnih molekul, ki prenašajo informacije znotraj in zunaj celic. Glavno
vlogo pri tem igrata citokrom C oksidaza (kompleks IV), ter ATP sintaza, veliki
transmembranski molekuli, prek katerih poteka izmenjava snovi, vode, vodikovih
ionov (protonov) in elektronov, ter nekaterih pomembnih molekul, predvsem
izmenjava adenozin-difosfata ADP in adenozin-trifosfata (ATP). ATP molekula je
ključni gradnik mišic, omogoča gibanje in dihanje, sodeluje pa tudi pri
znotraj- in zunaj-celični signalizaciji. Sl.5 shematsko prikazuje zapletene
proces v mitohondrijih.
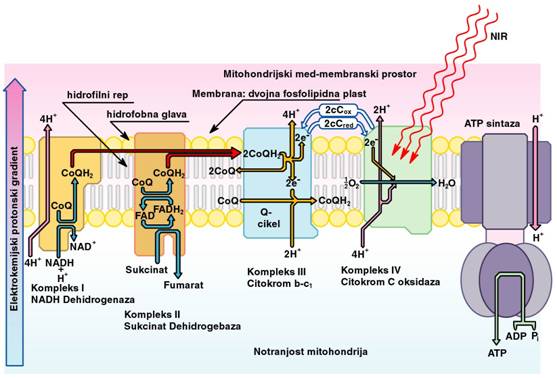
Sl.5: Shematski prikaz transporta
elektronov in protonov v mitohondrijih
½ NADH + cCox + ADP + P(n) ↔ ½ NAD+ + cCred +
ATP
FAD + Sukcinat → FADH2
+ Fumarat
4Fe2+–cCox + 8H+(n) + O2
→ 4Fe3+–cCox + 2H2O + 4H+(z)
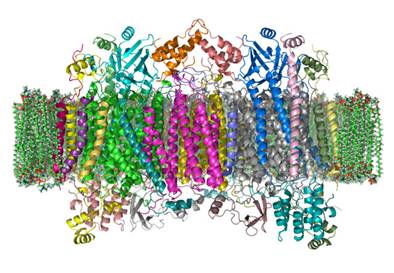
Sl.6: Računalniški model citokrom C
oksidaze v membrani mitohondrija
Nadaljnji pomembni proces je generiranje in
vzdrževanje celičnega trans-membranskega električnega potenciala. Celične membrane so debele le
kakih 10-20 atomov (~10–9m), celični potencial pa znaša okoli
70μV, kar pomeni da je električna poljska jakost na membrani ~70kV/m! Tako
visoka jakost polja in dejstvo, da sta tako zunanjost kot notranjost celice
električno prevodni tekočini (elektrolit) je razlog, da celice niso občutljive na močna zunanja elektromagnetna polja s frekvencami nižjimi
od 300GHz (če naj zunanje polje modulira električni potencial celice, mora
imeti valovno dolžino primerljivo z velikostjo celice in ustrezno jakost!).
Nekateri katalitično podprti procesi so v živčnih
celicah in sinapsah, kjer ob pomoči ionov (Na+, K+, Ca+,...)
poteka generiranje in prenos električnih impulzov. Nadalje
najdemo nizko-energijske procese pri inhibitornih in stimulatornih
medproteinskih reakcijah, pri ribosomskih transkripcijah DNK in RNK, pri
povezovanju fibroblastov in osteoblastov, in celo imunskih reakcijah (aktivnost
makrofagov).
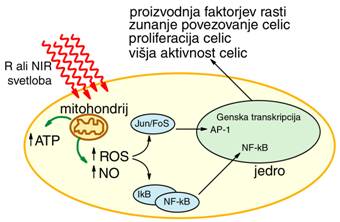
Sl.7: Shematski prikaz celične
signalizacije
Mnogi izmed teh procesov so že dobro
dokumentirani, a za večino še ni zanesljivih podatkov, tako glede njihove
foto-občutljivosti, kot tudi učinka, ali povezanosti z drugimi procesi.
Za nizko-energijsko svetlobno
terapijo je značilen obstoj optičnega »okna«, gre za spektralno območje med
600–1400nm (rdeča svetloba in bližnje IR) v katerem je prepustnost kože in
mišičnega tkiva razmeroma velika. Fotoni
z valovno dolžino v tem območju prodirajo globoko v tkivo in ob tem prihaja le
delno do sipanja in atenuacije svetlobe. Okno tvorijo spektralne funkcije
vodnih molekul, hemoglobina (oksigeniranega in neoksigeranega) in melanina. Atenuacijski
spekter kaže Sl.8.
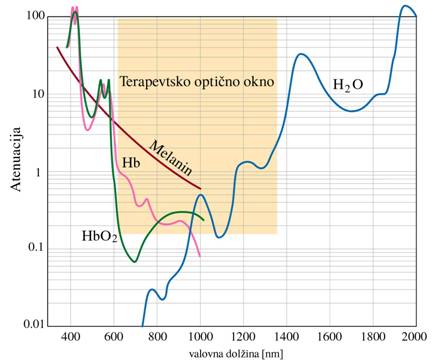
Sl.8: Atenuacijski spekter vode,
hemoglobina in melanina
Nekaj svetlobe se reflektira že na
površini kože. Preostala svetloba zaide v notranjost tkiva in se bodisi sipa
bodisi absorbira na različnih plasteh kože in tkiva. Manjši del pa prepotuje tkivo in uide. Voda atenuira
predvsem svetlobo dolge valovne dolžine (>1300nm), med tem ko melanin in hemoglobin atenuirata pretežno svetlobo krajše
valovne dolžine (<600nm). Svetloba ki preostane je na
voljo za absorpcijo s strani foto-občutljivih molekul. Poudariti
je treba da je za terapevtski učinek svetlobe pomembna le absorpcija, ker ta
dviguje posreduje energijo foto-občutljivim molekulam; vdorna globina svetlobe
je drugotnega pomena. V tem smislu
je zelo priporočljivo izmeriti individualne karakteristike refleksije, sipanja
in transparentnosti, ter na osnovi teh meritev sklepati na gostoto svetlobe ki
je na voljo za absorpcijo.
Prav zaradi težav z določanjem absorbirane količine svetlobe, nenatančnega
poznavanja karakterističnih absorpcijskih valovnih dolžin pomembnih molekul,
ter težko določljivih parametrov pretvorbe energije in transporta snovi obstaja
problem določanja doziranja pri svetlobni terapiji. Zaenkrat se zanašamo
predvsem na statistično obravnavo in izkušnje. Pomemben parameter je tudi
omejenost celičnih resursov, ko so ti izrabljeni potrebuje celica določen čas
za njihovo obnovo. V tem času lahko nastopi tudi problem predoziranja, zaradi
morebitnega pospeševanja nasprotnih procesov v primeru pomanjkanja določenih
snovi. Graf na Sl.9 kaže tipični reakcijski čas glede na posredovano dozo
sevanja. Ob začetnih majhnih dozah vedno opažamo določeno zakasnitev v odzivu,
dokler ne pride do transporta spremenjenih snovi in njihove povečane
koncentracije kot reakcije na sprejeto sevanje. Nato reakcija približno sledi
sprejeti dozi dokler ni dosežen prag, ki je posledica omejene hitrosti
transporta snovi in omejenih celičnih resursov, ter hitrosti delovanja
celičnega metabolizma. Ko je ta prag dosežen, podaljšano obsevanje ponavadi zmanjša
dosežene učinke, kar poteka različno hitro, odvisno od vrste procesa. Prav tako
po doseženi optimalni dozi in prenehanju obsevanja pride do zmanjšanja
terapevtskih učinkov zaradi naravne reakcije organizma in procesa obnove
celičnih zalog, vendar je to zmanjšanje običajno počasnejše kot pri
predoziranju.
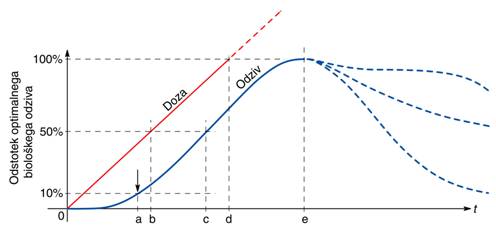
Sl.9: Vpliv sprejete terapijske
doze sevanja na biološki odziv
Viri:
Preto, J., Pettini, M.: Long-range resonant
interactions in biological systems
arXiv, Jan. 2012, <http://arxiv.org/abs/1201.5187v1>
Desmet, K.D., et al.: Clinical and
Experimental Applications of NIR-LED Photobiomodulation
Photomedicine and Laser Surgery,
Volume 24, Number 2, 2006
© Mary Ann Liebert, Inc., Pp.
121–128
Hamblin, M.R., Demidova, T.N.: Mechanisms of Low
Level Light Therapy.
(Mechanisms for Low-Light Therapy, edited by Hamblin,
M.R., Waynant, R.W., Anders,J.,)
Proc. of SPIE Vol. 6140, 614001,
(2006) · 1605-7422/06/$15
doi: 10.1117/12.646294
Karu, T.: Mitochondrial
Mechanisms of Photobiomodulation in Context of
New Data About
Multiple Roles of ATP
Photomedicine and Laser
Surgery, Volume 28, Number 2, 2010
Mary Ann Liebert, Inc., Pp.
159–160
doi: 10.1089=pho.2010.2789
Yuan, P., et al.: Open structure
of the Ca2+ gating ring in the high-conductance Ca2+-activated
K+ channel
Nature, 2011, doi:10.1038/nature10670
Vladimirov, Yu.A., et al.: Photobiological
Principles of Therapeutic Applications of Laser Radiation
Biochemistry (
Dorner, R., et al.: Quantum
coherent contributions in biological electron transfer
arXiv [q-bio.BM], Nov. 2011, <http://arxiv.org/abs/1111.1646v2>
Engel, G.S., et al.: Evidence for
wavelike energy transfer through quantum coherence in photosynthetic systems
Nature 446, 782-786
(2007).
Schmiegelow, C.T.,
Schmidt-Kaler, F.: Light with orbital angular
momentum interacting with trapped ions
arXiv [physics.atom-ph], Dec.
2011,
<http://arxiv.org/abs/1112.3377v1>
Fischer, T., Vink, R.L.C.: Membrane lateral
structure:
The influence of immobilized
particles on domain size
arXiv [cond-mat.soft], May
2012,
<http://arxiv.org/abs/1205.1001v1>
Heimburg, T.: The capacitance and
electromechanical coupling of lipid membranes close to transitions. The effect of electrostriction.
arXiv [physics.bio-ph], Jun
2012, <http://arxiv.org/abs/1206.2744v1>
Tewari, S.G., et al.: A Biophysical
Model of the Mitochondrial ATP-Mg/Pi Carrier
arXiv, Jun 2012, <http://arxiv.org/abs/1206.7053>
Cundina, L.X., Roach, W.P.: Kramers-Krönig
analysis of biological skin
arXiv, Oct. 2010, <http://lanl.arxiv.org/abs/1010.3752v1>